
Efecto de abonos foliares líquidos
orgánicos en la calidad de plantones de cedro colorado (Cedrela odorata l.),
en fase de vivero
Effect of organic liquid foliar fertilizers
on the quality of red cedar seedlings (Cedrela odorata L.), in the nursery
phase
Efeito de adubos foliares líquidos
orgânicos na qualidade de mudas de cedro vermelho (Cedrela odorata L.), na fase
de viveiro.
Adiel Alvarez Ticllasuca
Universidad Nacional Autónoma
de Tayacaja Daniel Hernández Morillo, Perú
adielalvarez@unat.edu.pe
Jairo Edson Gutiérrez
Collao
Universidad Nacional Autónoma
de Tayacaja Daniel Hernández Morillo, Perú
jairo.gutierrez@unat.edu.pe
Abner Abel Meza Calixto
Universidad Nacional Agraria
de la Selva, Perú
abelmezacalixto@gmail.com
Christian Edinson Murga
Tirado
Universidad Nacional Autónoma
de Tayacaja Daniel Hernández Morillo, Perú
christianmurga@unat.edu.pe
RESUMEN
El trabajo de investigación tuvo como finalidad
evaluar la predominación de 2 tipos de abono foliar líquido orgánico y 3 dosis,
en la calidad de plantones de Cedrela odorata L. Se aplicó un Diseño
Enteramente al Azar con arreglo factorial 2x3 y 5 repeticiones; los componentes
en análisis fueron: elemento A: AFLF y AFLH, y componente B: 50, 100 y 150
mL/20 L de agua, generando 6 tratamientos más un testigo; se instaló y evaluó
525 plantones a lo largo de 5 meses, después del cual la más grande elevación
de plantones (19,70 cm) se produjo con el T5 (150 mL de AFLF/20 L agua) y la
menor elevación (18,76 cm) con el T1 (50 mL de AFLF/20 L agua), con plantones
de calidad alta; el más grande diámetro (8,32 mm) se obtuvo con el T4 (100 mL
de AFLH/20 L agua) y el menor (7,41 mm) en el T0, con plantones de calidad
alta; muestran calidad alta de la interacción altura/diámetro o índice de
solidez; los plantones de los tratamientos T0, T1, T3, T4 y T6, presentan
calidad alta de la interacción tallo/raíz y los de los tratamientos T2 y T5
calidad media, el Índice de Calidad de Dickson indica la calidad media del
total de plantones tratados.
Palabras clave: Abono;
plantones; calidad; morfológicos.
ABSTRACT
The purpose of the research work was to evaluate the
predominance of 2 types of organic liquid foliar fertilizer and 3 doses, in the
quality of Cedrela odorata L seedlings. An Entirely Random Design was
applied with a 2x3 factorial arrangement and 5 repetitions; the components
under analysis were: element A: AFLF and AFLH, and component B: 50, 100 and 150
mL/20 L of water, generating 6 treatments plus a control; 525 seedlings were
installed and evaluated over 5 months, after which the highest seedling
elevation (19.70 cm) occurred with T5 (150 mL AFLF/20 L water) and the lowest
elevation (18, 76 cm) with T1 (50 mL AFLF/20 L water), with high quality
seedlings; the largest diameter (8.32 mm) was obtained with T4 (100 mL of
AFLH/20 L water) and the smallest (7.41 mm) in T0, with high quality seedlings;
show high quality of height/diameter interaction or solidity index; the
seedlings of the treatments T0, T1, T3, T4 and T6, present high quality of the
stem/root interaction and those of the treatments T2 and T5 average quality,
the Dickson Quality Index indicates the average quality of the total number of
seedlings treated.
Keywords: Fertilizer;
seedlings; quality; morphological.
RESUMO
O objetivo do trabalho de pesquisa foi avaliar a
predominância de 2 tipos de adubo foliar líquido orgânico e 3 doses, na
qualidade de mudas de Cedrela odorata L. Foi aplicado um Delineamento
Inteiramente Aleatório com arranjo fatorial 2x3 e 5 repetições; os componentes
analisados foram: elemento A: AFLF e AFLH, e componente B: 50,
100 e 150 mL/20 L de água, gerando 6 tratamentos mais uma testemunha; 525 mudas
foram instaladas e avaliadas ao longo de 5 meses, após os quais a maior
elevação das plântulas (19,70 cm) ocorreu com T5 (150 mL de AFLF/20 L de água)
e a menor elevação (18,76 cm) com T1 (50 mL de AFLF/ 20 L de água), com mudas
de alta qualidade; o maior diâmetro (8,32 mm) foi obtido com T4 (100 mL de
AFLH/20 L de água) e o menor (7,41 mm) em T0, com mudas de alta qualidade;
apresentam alta qualidade de interação altura/diâmetro ou índice de solidez; as
mudas dos tratamentos T0, T1, T3, T4 e T6 apresentam alta qualidade da
interação caule/raiz e as dos tratamentos T2 e T5 qualidade média, o Índice de Qualidade
de Dickson indica a qualidade média do número total de mudas tratadas.
Palavras-chave: Passar;
mudas; qualidade; morfológico.
INTRODUCCIÓN
El principal
problema de bosques y selvas tropicales es la sobreexplotación de especies
arbóreas consideradas preciosas (MARTÍNEZ y GARCÍA, 2007), lo cual según BRAVO
(2007), se debe a la calidad, durabilidad y color de la madera; situación en la
que se encuentra el cedro colorado (Cedrela odorata L.), por tratarse de
una especie que aporta grandes beneficios económicos para la industria
maderable.
El cambio de uso
de las tierras ejercido en las últimas décadas por el crecimiento demográfico y
las plagas, propician la degradación de los ecosistemas tropicales donde se
encuentran las poblaciones de Cedrela odorata L. con importancia
ecológica y económica para los seres vivos, surgiendo la necesidad de restaurar
dichas áreas mediante el establecimiento de plantaciones forestales
conservacionistas y de aprovechamiento forestal comercial (DE LA TORRE et al.,
2008), problema que se observa también en la provincia de Leoncio prado, donde
los remanentes de la referida especie forestal son cada vez menores, a lo que
se suma el periodo prolongado para su aprovechamiento.
La limitación de
recursos económicos implica que la planta forestal deberá producirse en el
menor tiempo posible, con la condición de que sea de buena calidad, para lograr
el éxito en el establecimiento y desarrollo de las plantaciones. Este es el
principal objetivo de un proyecto de inversión forestal y depende de muchos
factores, entre ellos la calidad de la planta (GARCÍA, 2011).
El éxito de la
plantación forestal radica en primera instancia, en la fase de vivero, dado que
en ella se define la calidad y potencial de la futura plantación, permitiendo
al viverista manipular algunas de las condiciones ambientales con acciones de
manejo que influyen en la morfología y fisiología de la planta (BIERCHLER et
al., 1998). En la determinación de la calidad de los plantones se utilizan
parámetros morfológicos y fisiológicos (GOMES et al., 2002).
En tal sentido,
la presente investigación trata de aportar al logro de plantaciones exitosas,
mediante la identificación de los parámetros óptimos que determinan la calidad
de los plantones de cedro colorado (Cedrela odorata L.) como alternativa
económica. Se plantea por tanto la interrogante: ¿el tipo y dosis de abono
orgánico fermentado influye en la producción de plantones de Cedrela odorata
L. de buena calidad?, generándose como respuesta la hipótesis: “el tipo de
abono orgánico fermentado empleado en la dosis adecuada, permite producir
plantones de Cedrela odorata L. de buena calidad”.
Un abono
orgánico liquido es cualquier material natural o industrializado, que contenga
al menos cinco por ciento de uno o más de los tres nutrientes primarios (N,
P2O5, K2O), puede ser llamado fertilizante. Fertilizantes fabricados
industrialmente son llamados fertilizantes minerales.
La presentación
de los fertilizantes minerales es muy variada. Dependiendo del proceso de
fabricación, las partículas de los fertilizantes minerales pueden ser de muy
diferentes tamaños y formas: gránulos, píldoras, «perlados», cristales, polvo
de grano grueso / compactado o fino. La mayoría de los fertilizantes es
provista en forma sólida. Los fertilizantes líquidos y de suspensión son
también importantes.
Beneficios de
los fertilizantes orgánicos
CESTA (2013)
sostiene que existe una diversidad de abonos orgánicos que se pueden utilizar
en el manejo de fincas diversificadas, entre estos tenemos: el compost, el
abono tipo bocashi, los biofermentados y abonos verdes. Además, existen los
microorganismos, que se utilizan mucho para activar la micro flora del suelo.
Los abonos antes
mencionados no son inventos nuevos, la mayoría de ellos las trabajaban nuestros
abuelos, pero ante la introducción de abonos químicos altamente sintéticos, las
prácticas tradicionales se están perdiendo. Por tanto, es necesario rescatar
estos conocimientos y transmitirlos a las futuras generaciones.
Abonos
orgánicos foliares
Asimismo, CESTA
(2013) indica que los abonos foliares a diferencia de los anteriores, son
líquidos, requieren menor cantidad de mano de obra, y se pueden producir
grandes volúmenes de una sola vez, por lo que resulta mucho más baratos que los
abonos sólidos.
El abono
foliar de frutas y plantas aromáticas
Según CESTA
(2013), el abono foliar de hojas o frutas es producto de la fermentación de
hojas o frutas de plantas previamente seleccionadas, las cuales son ricas en
nutrientes y vitaminas. Según el caso se necesitan cinco clases diferentes de
hojas o frutas. Si es de hojas se buscan cinco especies de la parcela que sean
de fácil o rápida descomposición, preferiblemente aromáticas (olorosas), que se
vean sanas y vigorosas. Según BERGER (2013), la ortiga aportará nitrógeno y
hierro.
En el foliar de
frutas se aprovechan desechos de frutas o frutas de segunda mano, cuidando de
no usar frutas ácidas (cítricos, maracuyá, piña, etc), por su alto contenido de
ácido cítrico (GÓMEZ y VÁSQUEZ, 2011). Se prefiere papaya, banano, melón,
sandía, guayaba, etc. La cantidad depende del tamaño del recipiente donde se va
a elaborar.
Calidad de
planta
En 1979 la Unión
Internacional de Organizaciones de Investigación Forestal (IUFRO) definió el término
calidad de planta en vivero como el grado con el cual cumple con los objetivos
de su utilización con el mismo costo (GARCÍA, 2002); es decir, la producción de
plántulas con el mejor crecimiento, manteniendo al mismo tiempo el balance
entre tallo y raíz que permitan la supervivencia de la misma en campo. Sin
embargo, la calidad de planta es relativa (SERRADA et al., 2005), ya que
depende del material genético y de las prácticas de cultivo en vivero (TORAL,
1997; ROJAS, 2002; VALENZUELA et al., 2005; GARCÍA, 2006) haciendo posible
definir diferentes tipos de calidad de planta.
Por su parte,
SERRADA et al. (2005) sostienen que en la actualidad se reconocen cuatro tipos
de calidad de planta, las cuales son: genética, biológica, fisiológica y
morfológica.
a.
Calidad genética. Se refiere a la procedencia de
la semilla, debido a que ésta debe de contribuir a generar árboles con
características deseables (fenotipo), las cuales a su vez sean heredables
(genotipo) (QUIROZ et al., 2001). El éxito en la producción de planta de buena
calidad genética depende de la experiencia para colectar semilla de rodales
seleccionados.
b.
Calidad biológica. Se busca obtener plantas
libres de parásitos, pero a su vez que la planta se encuentre asociada con
simbiontes (SERRADA et al., 2005) que le permitan establecerse en campo.
c.
Calidad fisiológica. Este tipo de calidad se
refiere al estado nutricional e hídrico, capacidad de formación de raíces y
resistencia a diversos fenómenos meteorológicos (GARCÍA, 2006; RODRÍGUEZ,
2008), que permiten el establecimiento de la planta en campo.
d.
Calidad morfológica. Es la respuesta fisiológica
de la planta a condiciones ambientales y a las prácticas de vivero (BIRCHLER et
al., 1998).
Indicadores
de calidad de planta
La calidad
morfológica y fisiológica de la planta ha sido estudiada ampliamente (DOMÍNGUEZ
et al., 1997; ROYO et al., 1997; VILLAR et al., 2000; VILLAR et al., 2001).
Los
investigadores forestales han trabajado para identificar variables
cuantificables que puedan ser usados como indicadores de una planta de calidad,
y mejor aún, para predecir su desempeño una vez establecida en campo. En tal
sentido, THOMPSON (1985), BIRCHLER et al. (1998), QUIROZ et al. (2001), GARCÍA
(2006), indican que las variables de tipo cuantitativo son la altura, diámetro
del cuello, pares de hojas, biomasa aérea, biomasa de raíces, forma y
desarrollo radicular, y consistencia del cepellón.
Para determinar
la calidad fisiológica también se han establecido variables tales como
potencial hídrico, capacidad para formar raíces, nutrientes, carbohidratos,
tensión (TORAL, 1997; BIRCHLER et al., 1998; DOMÍNGUEZ et al., 2001; GARCÍA,
2006), diacetato de fluoresceína, fluorescencia de la clorofila, concentración
de clorofila, tasa fotosintética, conductancia estomatal, dormancia de la yema,
emisiones volátiles inducidas por estrés, cloruro de trifenil tetrazolio,
termografía infrarroja, resonancia magnética nuclear y conductividad de
electrolitos (RODRÍGUEZ, 2008).
Interacción
de variables
DICKSON et al.
(1960) y THOMPSON (1985) afirman que la magnitud de las variables es difícil de
interpretar y en ocasiones resulta engañoso, por ello se han desarrollado
diferentes coeficientes o índices que permiten evaluar y determinar la calidad
de planta.
a.
Índice de robustez. Es la relación entre la
altura del brinzal (cm) y el diámetro del cuello de la raíz (mm) y debe ser
menor a seis y es un indicador de la resistencia de la planta a la desecación
por el viento, de la supervivencia y del crecimiento potencial en sitios secos.
El menor valor indica que se trata de árboles más bajos y gruesos, aptos para
sitios con limitación de humedad, ya que valores superiores a seis los dispone
a los daños por viento, sequía y helada (RODRÍGUEZ, 2008).
Junto con la altura y el diámetro del cuello de la raíz, la robustez
se considera una característica que influye en el desempeño temprano de la
plantación. Bajo condiciones favorables, la planta de mayor tamaño generalmente
crece mejor que planta más pequeña; sin embargo, planta más grande no sobrevive
tan bien como la de menor tamaño (Burdett, 1983; Thompson, 1984; Iverson, 1984
y Ritchie, 1984; citados por GARCÍA, 2007).
b.
Relación tallo/raíz o biomasa seca aérea/biomasa
seca raíz (R BSA/BSR). La producción de biomasa es importante debido a que
refleja el desarrollo de la planta en vivero. Una relación igual a uno,
significa que la biomasa aérea es igual a la subterránea; pero si el valor es
menor a uno, entonces la biomasa subterránea es mayor que la aérea; al
contrario, si el valor es mayor a uno, la biomasa aérea es mayor que la
subterránea (RODRÍGUEZ, 2008), por lo que una buena relación debe fluctuar
entre 1,5 y 2,5 ya que valores mayores indican desproporción y la existencia de
un sistema radical insuficiente para proveer de energía a la parte aérea de la
planta; el cociente de ésta relación no debe ser mayor a 2,5, particularmente
cuando la precipitación es escasa en los sitios de plantación (THOMPSON, 1985).
c.
Índice de Calidad de Dickson (ICD). Dado que
ninguna de estas características podría por si solas describir la calidad de
planta, Dickson et al. (1960), citados por PRIETO et al. (1999) desarrollaron
un índice de calidad que permite evaluar mejor las diferencias morfológicas
entre plantas de una muestra y predecir el comportamiento en campo. Este índice
es el mejor parámetro para indicar la calidad de planta, dado que expresa el
equilibrio de la distribución de la masa y la robustez, evitando seleccionar
plantas desproporcionadas y descartar planta de menor altura, pero con mayor
vigor (Fonseca et al., 2002; citado por GARCÍA, 2007). Asimismo, Dickson et al.
(1960), citados por PRIETO et al. (1999) sugieren que, a mayor valor del
índice, mejor calidad de planta.
MATERIALES
Y MÉTODOS
Lugar de
ejecución
La investigación
se realizó en el Vivero Forestal de la Facultad de Recursos Naturales
Renovables (FRNR) de la Universidad Nacional Agraria de la Selva (UNAS), y en
el Laboratorio de Anatomía de la Madera; ambos se ubican políticamente en el
distrito Rupa Rupa, provincia Leoncio Prado, región Huánuco. Geográficamente el
estudio se localiza en las coordenadas UTM: 390232 Este y 8970744 Norte. La
altitud promedio es de 660 msnm.
Materiales
Material genético
Plántulas de la especie forestal cedro colorado (Cedrela odorata L.).
Elaboración
del abono foliar líquido de frutas
Proceso
desarrollado teniendo en cuenta la metodología propuesta por CORECAF (2005) y
ARROYO (2009):
-
Previamente se adquirió mediante compra frutas
como: plátano, guayaba, mango y papaya, las mismas que luego fueron picadas en
pedazos pequeños, colocándolos alternadamente en el recipiente en una
proporción de 1 kg de frutas y 0,8 kg de melaza, hasta completar todo el
material.
-
Luego se colocó la tapa de madera y sobre ésta
una piedra en forma de prensa. Todo el material se mantuvo así durante ocho
días, hasta que se observó la presencia de burbujas.
-
Transcurrido los ocho días se pasó el contenido
por un colador, con la finalidad de eliminar las porciones no desintegradas.
-
El abono ya preparado fue guardado en
refrigeración haciendo uso de botellas oscuras, hasta el momento de ser usado.
Preparación
del abono foliar líquido de hojas
De manera
similar al caso anterior, este proceso fue realizado considerando la
metodología propuesta por CORECAF (2005) y ARROYO (2009), y consistió en lo
siguiente:
-
Las hojas de mango, papaya, carambola, guaba y
ortiga, colectadas de algunos predios agrícolas de la provincia, fueron picadas
en pedazos pequeños, los mismos que fueron colocados alternadamente en el recipiente
a razón de 1 kg de hojas y 0,8 kg de melaza, hasta completar todo el material.
-
Se colocó luego la tapa de madera y sobre ésta
una piedra en forma de prensa, manteniendo así el material durante ocho días
hasta la formación de burbujas.
-
Transcurrido los ocho días se pasó el contenido
por un colador para eliminar partes de hojas no desintegradas.
-
El abono ya preparado fue refrigerado en
botellas oscuras, hasta el momento de ser usado.
Evaluación
La primera
evaluación de altura y diámetro basal fue registrada al día siguiente del
repique, en tanto las restantes fueron realizadas cada 30 días, por un periodo
de cinco meses (150 días); en total se registraron seis evaluaciones. La
cuantificación de biomasa por su parte, se realizó al final del estudio, es decir,
a cinco meses posteriores al repique, para lo cual los plantones fueron
extraídos de manera manual de las bolsas y sometidos a lavados retirando el
sustrato de las raíces. Las características morfológicas evaluadas fueron:
a.
Altura de plantones (cm)
b.
Diámetro basal del tallo de plantones (mm)
c.
Biomasa de la parte aérea y del sistema
radicular (g)
Con las
variables anteriormente descritas, se determinaron los siguientes índices de
calidad de planta:
1. Relación
altura/diámetro del tallo de los plantones o índice de robustez (IR).
Relaciona la
altura (cm) y el diámetro del tallo a nivel del cuello de la raíz (mm) del
plantón y se estimó mediante la fórmula propuesta por Roller (1977), citado por
THOMPSON (1985):
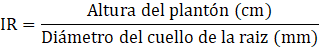
2. Relación
tallo/raíz o biomasa seca aérea/biomasa seca raíz (R BSA/BSR).
Refleja el
desarrollo de la planta en vivero, la misma que fue calculada mediante la
fórmula planteada por Herman (1964), citado por THOMPSON (1985):

3. Índice
de Calidad de Dickson (ICD).
Reúne varios
atributos morfológicos en un solo valor que es usado como índice de calidad. A
mayor valor de índice resultará una mejor calidad de planta, y fue calculado
con la fórmula sugerida por DICKSON et al. (1960):
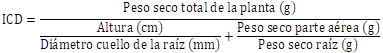
La clasificación de los índices de calidad
para los atributos morfológicos de latifoliadas se presenta en la tabla 1.
Tabla 1
Clasificación de los índices de calidad para los
atributos morfológicos de latifoliadas.
|
Variable
|
Calidad
|
|
Baja
|
Media
|
Alta
|
|
Altura (cm)
|
< 12,0
|
12,0 – 14,9
|
≥ 15,0
|
|
Diámetro (mm)
|
< 2,5
|
2,5 – 4,9
|
≥ 5,0
|
|
Índice de robustez
|
≥ 8,0
|
7,9 – 6,0
|
< 6,0
|
|
Relación BSA/BSR
|
≥ 2,5
|
2,4 – 2,0
|
< 2,0
|
|
Índice de Calidad de Dickson
|
< 0,2
|
0,2 – 0,4
|
≥ 0,5
|
Fuente: SÁENZ et al. (2010).
Diseño
experimental
El diseño
experimental propuesto corresponde a un Diseño Completamente al Azar con
arreglo factorial 2 x 3 con cinco repeticiones. Los factores en fueron:
Factor A: abono
foliar líquido. Tipos: de frutas (AFLF), de hojas (AFLH).
Factor B: dosis. Niveles:
50, 100 y 150 mL/20 L de agua.
La combinación
de los factores descritos generó seis tratamientos más un testigo, haciendo un
total de siete tratamientos (Tabla 2).
Tabla 2
Tratamientos del experimento factorial.
|
Tratamientos
|
Tipo de abono
foliar líquido orgánico
|
Dosis
|
|
T0
|
--
|
--
|
|
T1
|
AFLF
|
50 mL/20 L de
agua
|
|
T2
|
AFLH
|
50 mL/20 L de
agua
|
|
T3
|
AFLF
|
100 mL/20 L de
agua
|
|
T4
|
AFLH
|
100 mL/20 L de agua
|
|
T5
|
AFLF
|
150 mL/20 L de
agua
|
|
T6
|
AFLH
|
150 mL/20 L de
agua
|
Cada tratamiento estuvo constituido por 75 plantones; es decir, 15
por cada unidad experimental. En total se evaluaron 525 plantones de cedro
colorado (Cedrela odorata L.).
Modelo estadístico
Yij = μ + Factor Ai + Factor Bj + Factor Ai * Factor Bj +
ɛ
Donde:
Yij: Respuesta esperada del i-ésimo factor A con el
j-ésimo factor B.
Μ: Media de las unidades experimentales.
Factor Ai: Efecto del i-ésimo factor A (abono foliar
líquido)
Factor Bj: Efecto del j-ésimo factor B (dosis).
Factor Ai * Factor Bj : Efecto de la interacción del
i-ésimo factor A con el j-ésimo factor B.
ɛ: Error experimental.
El análisis de varianza se realizó con el software estadístico
InfoStat 2016 versión estudiantil libre, y la diferencia de promedios fue
calculada mediante la diferencia mínima significante de Fisher cuando el valor
de p<0.05 (STEEL y TORRIE, 1988).
El modelo de la
factorial versus el testigo se detalla en el Tabla 3. La comparación entre los
tratamientos de la factorial versus el testigo se realizó mediante un contraste
incluido en el modelo. Asimismo, se analizaron las tendencias de crecimiento
(altura y diámetro) en los tratamientos en estudio.
Tabla
3
ANVA del experimento factorial.
|
Fuente de
Variabilidad
|
G.L.
|
|
Tratamientos
|
6
|
|
Factorial
|
5
|
|
Abono foliar líquido
|
1
|
|
Dosis
|
2
|
|
Abono foliar líquido * dosis
|
2
|
|
Testigo Vs. factorial
|
1
|
|
Error
experimental
|
28
|
|
Total
|
34
|
RESULTADOS
Altura de
plantones
Se presenta el
análisis de varianza para la altura de los plantones en seis periodos de
evaluación, que corresponden a un total de cinco meses.
En la sexta
evaluación se comprueba la existencia de diferencias estadísticas (p<0,05).
Es importante mencionar que en cada evaluación realizada se observa un bajo
coeficiente de variación, el cual determina una alta homogeneidad entre las
mediciones en cada tratamiento (Tabla 4).
Tabla 4
Análisis de varianza para la altura de los plantones en la sexta
evaluación, al 5% de nivel de significancia.
|
Fuentes de variación
|
GL
|
Sexta Evaluación
|
|
CM
|
p-valor
|
|
|
Tratamientos
|
6
|
0,7875
|
<0,0001
|
**
|
|
Factorial
|
5
|
0,7727
|
<0,0001
|
**
|
|
Abono foliar
|
1
|
0,0067
|
0,5215
|
ns
|
|
Dosis
|
2
|
1,6883
|
<0,0001
|
**
|
|
Abono foliar * dosis
|
2
|
0,2402
|
0,0001
|
**
|
|
Testigo Vs. factorial
|
1
|
0,8614
|
<0,0001
|
**
|
|
Error
|
28
|
0,0175
|
|
|
|
Total
|
34
|
|
|
|
|
CV%
|
0,69%
|
|
|
|
|
|
|
(ns) no significativo; (*)
significativo; (**) altamente significativo.
Al aplicar dosis de 100 y 150 mL, se produjo un evidente efecto del
tipo de abono foliar sobre la altura de los plantones (p<0,05); tanto así
que con dosis de 100 mL se observa que los plantones que adquirieron mayor
altura fueron los fertilizados con el AFLH (19,56 cm), seguido por los producidos
con AFLF logrando 19,30 cm; sin embargo, al aplicarse una dosis de 150 mL los
resultados se invierten, obteniendo mayor altura los plantones fertilizados con
AFLF (19,70 cm) versus los producidos con AFLH, que alcanzaron 19,34 cm (Tabla
5).
Tabla 5
Altura media de plantones como efecto del tipo de
abono foliar en cada dosis (promedio ± error estándar).
|
Dosis (Factor
B)
|
Abono foliar
|
Altura (cm)
|
|
50 mL/20 L agua
|
Frutas
|
(AFLF)
|
18,76
|
± 0,04
|
a
|
|
Hojas
|
(AFLH)
|
18,77
|
± 0,06
|
a
|
|
p-valor
|
0,8964
|
|
100 mL/20 L
agua
|
Frutas
|
(AFLF)
|
19,30
|
± 0,02
|
b
|
|
Hojas
|
(AFLH)
|
19,56
|
± 0,02
|
a
|
|
p-valor
|
0,0001
|
|
150 mL/20 L
agua
|
Frutas
|
(AFLF)
|
19,70
|
± 0,06
|
a
|
|
Hojas
|
(AFLH)
|
19,34
|
± 0,10
|
b
|
|
p-valor
|
0,0125
|
Letras
diferentes en la misma columna indican diferencias estadísticas según prueba de
Fisher al 5% de nivel de significancia
Al utilizar
AFLF, la mayor altura del plantón se logró con la dosis de 150 mL (19,70 cm),
seguido por las dosis de 100 mL (19,30 cm) y 50 mL (18,76 cm); en tanto al
fertilizar con AFLH, la mayor altura de los plantones se obtuvo con las dosis
de 100 y 150 mL (19,56 y 19,34 cm, respectivamente) -resultados
estadísticamente similares-, seguidos de la dosis 50 mL, con la que se logró
18,77 cm (Tabla 6).
Tabla 6
Altura media de plantones como efecto de las dosis empleadas en cada
tipo de abono foliar (promedio ± error estándar)
|
Abono foliar
(factor A)
|
Dosis
|
Altura (cm)
|
|
AFLF
|
150 mL/20 L
agua
|
19,70
|
± 0,06
|
a
|
|
|
100 mL/20 L
agua
|
19,30
|
± 0,02
|
b
|
|
50 mL/20 L agua
|
18,76
|
± 0,04
|
c
|
|
p - valor
|
<0,0001
|
|
AFLH
|
100 mL/20 L
agua
|
19,56
|
± 0,02
|
a
|
|
150 mL/20 L
agua
|
19,34
|
± 0,10
|
a
|
|
50 mL/20 L agua
|
18,77
|
± 0,06
|
b
|
|
p - valor
|
<0,0001
|
|
|
|
|
|
|
|
Letras
diferentes en la misma columna indican diferencias estadísticas según prueba de
Fisher al 5% de nivel de significancia
En la sexta
evaluación los plantones del tratamiento testigo logran alturas
estadísticamente similares a los fertilizados con dosis de 50 mL,
indistintamente al tipo de abono foliar empleado; con estos resultados se puede
afirmar que al emplear dosis de 50 mL los plantones adquieren alturas similares
a los no fertilizados (testigo), por lo que, con el fin de obtener resultados
diferentes, las dosis a usar deben superar los 50 mL. Finalmente, se observa
que en la última evaluación el T5 (150 mL de AFLF/20 L agua) produjo mayor
altura promedio de los plantones (19,70 cm), seguido del T4 (100 mL de AFLH/20
L agua) con 19,56 cm; en tanto con el T1 (50 mL de AFLF/20 L agua) se generó la
menor altura promedio, con 18,76 cm (Tabla 7).
Tabla 7
Altura media de los plantones en cada tratamiento, en la sexta
evaluación (promedio ± error estándar)
|
Tratamiento
|
Sexta Evaluación
|
|
T0
|
Testigo
|
18,79
|
± 0,07
|
c
|
|
T1
|
50 mL AFLF/20 L agua
|
18,76
|
± 0,04
|
c
|
|
T2
|
50 mL AFLH /20 L agua
|
18,77
|
± 0,06
|
c
|
|
T3
|
100 mL AFLF/20 L agua
|
19,3
|
± 0,02
|
b
|
|
T4
|
100 mL AFLH/20 L agua
|
19,56
|
± 0,02
|
a
|
|
T5
|
150 mL AFLF/20 L agua
|
19,7
|
± 0,06
|
a
|
|
T6
|
150 mL AFLH/20 L agua
|
19,34
|
± 0,10
|
b
|
|
p-valor
|
<0,0001
|
Letras
diferentes en la misma columna indican diferencias estadísticas según prueba de
Fisher al 5% de nivel de significancia
Asimismo, se
muestra un resumen de los contrastes entre el testigo versus los tratamientos
de la factorial (dosis y tipo de abono foliar); como puede observarse, en la
sexta evaluación se muestra un claro comportamiento superior estadísticamente
diferenciado, de la factorial sobre el testigo (Tabla 8).
Tabla 8
Altura media de los plantones entre el testigo
versus factorial, en la sexta evaluación (promedio ± error estándar)
|
Contrastes
|
Sexta Evaluación
|
|
Testigo
|
18,79
|
± 0,07
|
b
|
|
Factorial
|
19,24
|
± 0,07
|
a
|
|
p-valor
|
<0,0001
|
Letras diferentes en la misma columna indican diferencias
estadísticas según prueba de Fisher al 5% de nivel de significancia
Las tendencias
de crecimiento en cada tratamiento a través de ecuaciones lineales muestran que
cada una de ellas presenta un elevado r-cuadrado, lo cual explica el porcentaje
con el que los datos se ajustan al modelo predictivo (Tabla 9).
Tabla 9
Tendencias lineales del crecimiento de la altura para cada
tratamiento en estudio
|
Tratamientos
|
Ecuación lineal
|
R2
|
|
T0
|
Testigo
|
Y= 3,1563X –
1,4653
|
0,92
|
|
T1
|
50 ml AFLF/20 L agua
|
Y= 3,1737X –
0,7380
|
0,97
|
|
T2
|
50 ml AFLH/20 L agua
|
Y= 3,1826X –
0,8173
|
0,96
|
|
T3
|
100 ml AFLF/20 L agua
|
Y= 3,2583X –
0,8673
|
0,96
|
|
T4
|
100 ml AFLH/20 L agua
|
Y= 3,3363X –
1,0520
|
0,96
|
|
T5
|
150 ml AFLF/20 L agua
|
Y= 3,3406X –
0,9253
|
0,97
|
|
T6
|
150 ml AFLH/20 L agua
|
Y= 3,2020X –
0,5153
|
0,98
|
Así también, se
describe las tendencias lineales de crecimiento entre el testigo y el
factorial, observándose pendiente positiva y un r-cuadrado aceptable (Tabla
10).
Tabla 10
Tendencias lineales del crecimiento de la altura
para el testigo y el factorial.
|
Contrastes
|
Ecuación lineal
|
R2
|
|
Testigo
|
Y= 3,2495X -
0,8217
|
0,97
|
|
Factorial
|
Y= 3,1565X -
1,4676
|
0,92
|
Diámetro de
plantones
Parámetro para
el cual se realizó el análisis de varianza durante los cinco meses de
evaluación; se puede observar que en la sexta evaluación se manifiestan
diferencias estadísticamente significativas tanto en el factorial y el
contraste.
Por otra parte,
se observa que los diámetros en estudio en los diferentes tratamientos
presentan una alta homogeneidad de valores, dado que presentan coeficientes de
variación menores a 5% (Tabla 11).
Tabla 11
Análisis de varianza para el diámetro de los
plantones en la sexta evaluación, al 5% de nivel de significancia
|
Fuentes
de variación
|
GL
|
Sexta
Evaluación
|
|
CM
|
p-valor
|
|
Tratamientos
|
6
|
0,5788
|
<0,0001
|
**
|
|
Factorial
|
5
|
0,5124
|
<0,0001
|
**
|
|
Abono foliar
|
1
|
0,0074
|
0,5168
|
ns
|
|
Dosis
|
2
|
1,1881
|
<0,0001
|
**
|
|
Abono foliar * dosis
|
2
|
0,0893
|
0,0128
|
*
|
|
Testigo Vs. factorial
|
1
|
0,9108
|
0,0034
|
*
|
|
Error
|
28
|
0,0163
|
|
|
|
Total
|
34
|
|
|
|
|
CV%
|
1,64%
|
|
ns) no
significativo; (*) significativo; (**) altamente significativo.
Al analizar el
diámetro de tallo de los plantones como efecto de los tipos de abono foliar en
cada dosis, se observa que al aplicar las dosis de 50 y 150 mL/20 L agua, no se
generan diferencias estadísticamente significativas entre los tipos de abono
foliar (p>0,05); es decir, al emplear dosis de 50 mL/20 L agua, con el AFLF
se obtuvo 7,53 mm y con AFLH se logró 7,48 mm; al utilizar 150 mL/20 L agua,
con AFLF se generó 7,95 mm y al usar AFLH 7,85 mm. No obstante, al aplicar 100
ml/20 L agua, sí se evidencian diferencias estadísticas (p<0,05), obteniendo
con el AFLH el mayor diámetro promedio (8,32 mm) y con el AFLF 8,07 mm (Tabla
12).
Taba 12
Diámetro del tallo como efecto de los tipos de
abono en cada dosis, para la sexta evaluación (promedio ± error estándar)
|
Dosis
|
Abono Foliar
|
Diámetro (mm)
|
|
50 mL/20 L agua
|
Frutas
|
(AFLF)
|
7,53
|
± 0,04
|
a
|
|
Hojas
|
(AFLH)
|
7,48
|
± 0,05
|
a
|
|
p-valor
|
0,3923
|
|
100 mL/20 L agua
|
Hojas
|
(AFLH)
|
8,32
|
± 0,06
|
a
|
|
Frutas
|
(AFLF)
|
8,07
|
± 0,08
|
b
|
|
p-valor
|
0,0296
|
|
150 mL/20 L agua
|
Frutas
|
(AFLF)
|
7,95
|
± 0,08
|
a
|
|
Hojas
|
(AFLH)
|
7,85
|
± 0,04
|
a
|
|
p-valor
|
0,2968
|
Letras
diferentes en la misma columna indican diferencias estadísticas según prueba de
Fisher al 5% de nivel de significancia.
Se muestra ahora
el análisis inverso, es decir, el diámetro de tallo como efecto de las dosis
por cada tipo de abono foliar. Como puede observarse, en ambos tipos de abono
foliar se encuentran diferencias estadísticamente significativas entre las
dosis de aplicación (p<0,05). Al aplicarse el abono AFLF, los mayores
diámetros de tallo se lograron con dosis de 100 y 150 mL (8,07 y 7,95 mm,
respectivamente), seguidos de la dosis de 50 mL (7,53 mm). Al fertilizar con
abono foliar AFLH, el mayor diámetro de tallos se obtuvo con la dosis de 100
mL/20 L agua (8,32 mm), seguido de las dosis de 150 y 50 mL, con las que se
alcanzaron 7,85 y 7,48 mm, respectivamente (Tabla 13).
Tabla 13
Diámetro del tallo como efecto de las dosis en cada tipo de abono
foliar, en la sexta evaluación (promedio ± error estándar).
|
Abono Foliar
|
Dosis
|
Diámetro (mm)
|
|
AFLF
|
100 mL/ 20 L
agua
|
8,07
|
± 0,08
|
a
|
|
150 mL/ 20 L
agua
|
7,95
|
± 0,08
|
a
|
|
50 mL/ 20 L
agua
|
7,53
|
± 0,04
|
b
|
|
p - valor
|
0,0003
|
|
AFLH
|
100 mL/ 20 L agua
|
8,32
|
± 0,06
|
a
|
|
150 mL/ 20 L
agua
|
7,85
|
± 0,04
|
b
|
|
50 mL/ 20 L
agua
|
7,48
|
± 0,05
|
c
|
|
p - valor
|
<0,0001
|
Letras
diferentes en la misma columna indican diferencias estadísticas según prueba de
Fisher al 5% de nivel de significancia.
Las diferencias
estadísticas entre el testigo versus el factorial (p<0,05), muestran que los
plantones del factorial obtuvieron mayor diámetro de tallo (7,87 mm) respecto a
los del testigo, quienes lograron 7,41 mm (Tabla 14).
Tabla 14
Diámetro medio del tallo comparado entre el testigo
versus el factorial, en la sexta evaluación (promedio ± error estándar).
|
Contrastes
|
Diámetro del
tallo (mm)
|
|
Testigo
|
7,41
|
± 0,05
|
b
|
|
Factorial
|
7,87
|
± 0,06
|
a
|
|
p-valor
|
0,0034
|
Letras
diferentes en la misma columna indican diferencias estadísticas según prueba de
Fisher al 5% de nivel de significancia.
El análisis
temporal del diámetro medio de tallo de los tratamientos en las seis evaluaciones,
muestra las tendencias de crecimiento. Al término del experimento, el mayor
diámetro de tallo se obtuvo con el tratamiento 4 (100 mL de AFLH/20 L agua) con
8,32 mm, seguido del T3 (100 mL de AFLF/20 L agua) con 8,07 mm; en tanto el
menor diámetro se logró con el T0, alcanzando 7,41 mm (Tabla 15).
Tabla 15
Diámetro medio de los plantones en cada tratamiento, en la sexta
evaluación (promedio ± error estándar).
|
Tratamiento
|
Sexta
Evaluación
|
|
T0
|
Testigo
|
7,41
|
± 0,05
|
c
|
|
T1
|
50 mL AFLF/20 L agua
|
7,53
|
± 0,04
|
c
|
|
T2
|
50 mL AFLH /20 L agua
|
7,48
|
± 0,05
|
c
|
|
T3
|
100 mL AFLF/20 L agua
|
8,07
|
± 0,08
|
b
|
|
T4
|
100 mL AFLH/20 L agua
|
8,32
|
± 0,06
|
a
|
|
T5
|
150 mL AFLF/20 L agua
|
7,95
|
± 0,08
|
b
|
|
T6
|
150 mL AFLH/20 L agua
|
7,85
|
± 0,04
|
b
|
|
p-valor
|
<0,0001
|
Letras
diferentes en la misma columna indican diferencias estadísticas según prueba de
Fisher al 5% de nivel de significancia
Tabla 16
Diámetro medio de los plantones entre el testigo versus factorial,
en la sexta evaluación (promedio ± error estándar).
|
Contrastes
|
Sexta
Evaluación
|
|
Testigo
|
7,41
|
± 0,05
|
b
|
|
Factorial
|
7,87
|
± 0,06
|
a
|
|
p-valor
|
<0,0034
|
Letras
diferentes en la misma columna indican diferencias estadísticas según prueba de
Fisher al 5% de nivel de significancia
Las tendencias
lineales de crecimiento del diámetro (ecuaciones lineales) de los tratamientos
en estudio muestran que cada tratamiento tiene pendiente creciente (positiva),
así como un alto coeficiente de determinación (r-cuadrado), lo cual expresa una
alta confiabilidad de las ecuaciones (Tabla 17).
Tabla 17
Tendencias lineales del crecimiento de diámetro para cada
tratamiento en estudio
|
Tratamientos
|
Ecuación lineal
|
R2
|
|
T0
|
Testigo
|
Y= 1,2894X –
1,0148
|
0,93
|
|
T1
|
50 mL AFLF/20 L agua
|
Y= 1,2974X –
0,9961
|
0,94
|
|
T2
|
50 mL AFLH/20 L agua
|
Y=1,2872X –
0,8812
|
0,94
|
|
T3
|
100 mL AFLF/20 L agua
|
Y= 1,4097X –
1,1393
|
0,94
|
|
T4
|
100 mL AFLH/20 L agua
|
Y= 1,4599X –
1,1375
|
0,95
|
|
T5
|
150 mL AFLF/20 L agua
|
Y= 1,4242X –
1,1108
|
0,95
|
|
T6
|
150 mL AFLH/20 L agua
|
Y= 1,3727X –
1,0176
|
0,95
|
Las tendencias
lineales de los contrastes muestran una curva de crecimiento continuo, con alta
confiabilidad por cuanto su r-cuadrado supera el 93% (Tabla 18).
Tabla 18
Tendencias lineales del crecimiento de diámetro para el testigo y el
factorial
|
Contrastes
|
Ecuación lineal
|
R2
|
|
Testigo
|
Y= 1,2895X –
1,0157
|
0,93
|
|
Factorial
|
Y= 1,3752X –
1,0471
|
0,94
|
Relación
altura/diámetro o índice de robustez (IR)
Los valores
obtenidos de la relación altura/diámetro o índice de robustez por tratamiento
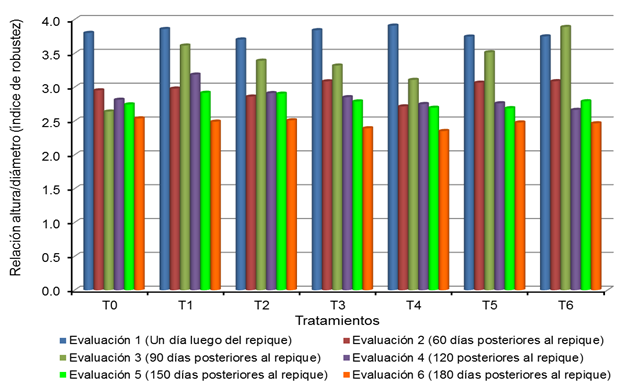
durante las seis evaluaciones, son mostrados en el Tabla 19 y Figura 1.
Tabla 19
Relación altura/diámetro (índice de robustez) de los plantones de Cedrela
odorata L. por tratamiento, a 1, 30, 6e0, 90, 120 y 150 días posteriores al
repique
|
Evaluación
|
Relación
altura/diámetro (índice de robustez) por tratamiento
|
|
T0
|
T1
|
T2
|
T3
|
T4
|
T5
|
T6
|
|
1 (Un día luego
del repique)
|
3,8
|
3,9
|
3,7
|
3,8
|
3,9
|
3,7
|
3,8
|
|
2 (30 días
posteriores al repique)
|
3,0
|
3,0
|
2,9
|
3,1
|
2,7
|
3,1
|
3,1
|
|
3 (60 días
posteriores al repique)
|
2,6
|
3,6
|
3,4
|
3,3
|
3,1
|
3,5
|
3,9
|
|
4 (90
posteriores al repique)
|
2,8
|
3,2
|
2,9
|
2,9
|
2,7
|
2,8
|
2,7
|
|
5 (120 días
posteriores al repique)
|
2,7
|
2,9
|
2,9
|
2,8
|
2,7
|
2,7
|
2,8
|
|
6 (150 días
posteriores al repique)
|
2,5
|
2,5
|
2,5
|
2,4
|
2,4
|
2,5
|
2,5
|
Figura 1
Relación altura/diámetro (índice de robustez) de los plantones de Cedrela
odorata L. por tratamiento, a 1, 30, 60, 90, 120 y 150 días luego del repique.
En el Tabla 22
se muestran los valores de la relación altura/diámetro o índice de robustez,
los mismos que presentan tendencia similar entre los tratamientos durante las
cinco evaluaciones, y considerando que la real importancia radica en conocer
este índice al final de la evaluación (a 150 días posteriores al repique), se
realizó el cálculo del mismo para el referido periodo (Tabla 20, Figura 1).
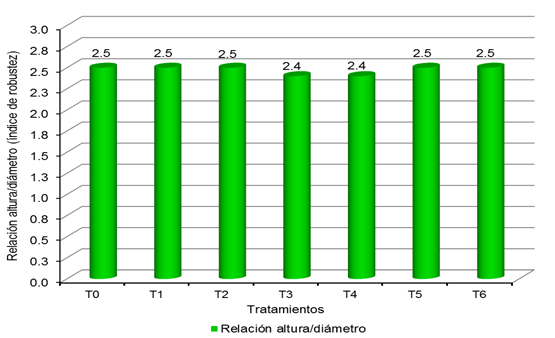
Se observa que
de acuerdo al Tabla 2 (SÁENZ et al., 2010), la totalidad de tratamientos
presenta calidad alta, alcanzando los siguientes valores: T0 = 2,5; T1 = 2,5;
T2 = 2,5; T3 = 2,4; T4 = 2,4; T5 = 2,5 y T6 = 2,5.
Tabla 20
Relación altura/diámetro (índice de robustez) de
los plantones de Cedrela odorata L. por tratamiento, a 150 días del repique.
|
Relación
altura/diámetro (índice de robustez) por tratamiento
|
|
T0
|
T1
|
T2
|
T3
|
T4
|
T5
|
T6
|
|
2,5
|
2,5
|
2,5
|
2,4
|
2,4
|
2,5
|
2,5
|
Figura
2
Relación altura/diámetro (índice de robustez) de
los plantones de Cedrela odorata L. por tratamiento, a 180 días del repique
Relación
tallo/raíz
Considerando que
la determinación de la biomasa de los plantones fue realizada en la última
evaluación (a 150 días después del repique), el cálculo de la relación
tallo/raíz de los plantones se realizó también al final del experimento (Tabla
21, Figura 3).
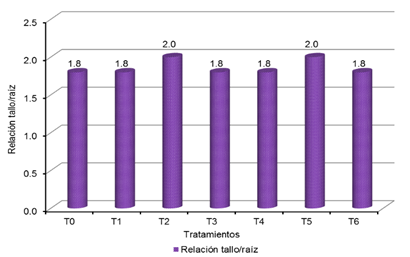
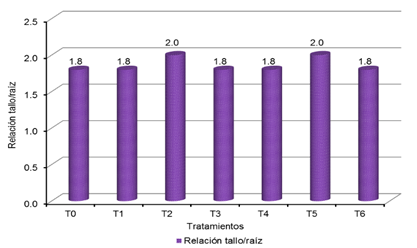
Se observa que
de acuerdo al Tabla 2 (SÁENZ et al., 2010), los tratamientos T0 = 1,8; T1 =
1,8; T3 = 1,8; T4 = 1,8 y T6 =1,8, presentan calidad alta, en tanto los
tratamientos T2 = 2,0 y T5 = 2,0 presentan calidad media.
Tabla 21
Relación tallo/raíz de los plantones de Cedrela
odorata L. por tratamiento, a 150 días posteriores al repique.
|
Relación tallo/raíz por tratamiento
|
|
T0
|
T1
|
T2
|
T3
|
T4
|
T5
|
T6
|
|
1,8
|
1,8
|
2,0
|
1,8
|
1,8
|
2,0
|
1,8
|
Figura
3
Relación tallo/raíz de los plantones de Cedrela odorata L. por tratamiento, a 150 días luego del repique.
Índice de
calidad de Dickson
De manera
similar al índice anterior, el Índice de Calidad de Dickson fue calculado luego
de la última evaluación (a 150 días posteriores al repique), cuyos
resultados se muestran en el Tabla 22, Figura 4.
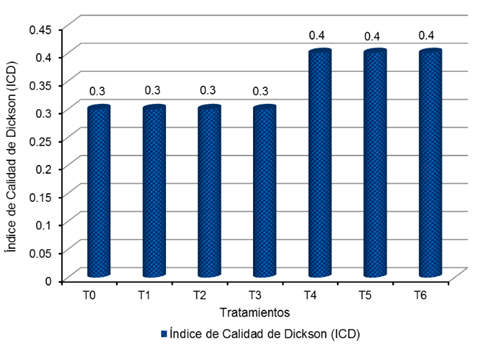
Se observa que
de acuerdo al Tabla 2 (SÁENZ et al., 2010), la totalidad de tratamientos
presenta calidad media (ICD = 0,2 - 0,4); es decir, T0 = 0,3; T1 = 0,3; T2 =
0,3; T3 = 0,3; T4 = 0,4; T5 = 0,4 y T6 = 0,4.
Tabla 22
Índice de Calidad de Dickson de los plantones de Cedrela
odorata L. por tratamiento, a 150 días luego del repique
|
Índice de Calidad de Dickson (ICD) por tratamiento
|
|
T0
|
T1
|
T2
|
T3
|
T4
|
T5
|
T6
|
|
0,3
|
0,3
|
0,3
|
0,3
|
0,4
|
0,4
|
0,4
|
Figura 3
Relación
tallo/raíz de los plantones de Cedrela odorata L. por tratamiento, a 150 días
luego del repique.
Índice de calidad de Dickson
De manera
similar al índice anterior, el Índice de Calidad de Dickson fue calculado luego
de la última evaluación (a 150 días posteriores al repique), cuyos
resultados se muestran en el Tabla 22, Figura 4.
Se observa que
de acuerdo al Tabla 2 (SÁENZ et al., 2010), la totalidad de tratamientos
presenta calidad media (ICD = 0,2 - 0,4); es decir, T0 = 0,3; T1 = 0,3; T2 =
0,3; T3 = 0,3; T4 = 0,4; T5 = 0,4 y T6 = 0,4.
Tabla 22
Índice de Calidad de Dickson de los plantones de Cedrela odorata L.
por tratamiento, a 150 días luego del repique.
Figura 4
Índice de Calidad de Dickson de los plantones de Cedrela odorata L.
por tratamiento, a 150 días después del repique
DISCUSIÓN
Los resultados
obtenidos muestran que con el T5 (150 mL de AFLF/20 L agua) se produjo la mayor
altura de plantones (19,70 cm) y con el T4 (100 mL de AFLH/20 L agua) el mayor
diámetro (8,32 mm); seguidos por el T4 (100 mL de AFLH/20 L agua) con 19,56 cm
y el T3 (100 mL de AFLF/20 L agua) con 8,07 mm. Por su parte, la menor altura
(18,76 cm) se generó con el T1 (50 mL de AFLF/20 L agua) y el menor diámetro
(7,41 mm) con el T0; respecto a la calidad de plantas según la altura de los
plantones, tomando los valores sugeridos por SÁENZ et al. (2010), los plantones
de la totalidad de tratamientos poseen calidad alta en altura (≥ 15,0 cm)
y en diámetro (≥ 5,0 mm).
Lo antes
explicado fundamenta y corrobora los resultados obtenidos en el presente
estudio, toda vez que por el tipo de fertilizante (abono foliar líquido) y
forma de aplicación, hubo un mejor aprovechamiento de las sustancias
producidas, permitiendo asimismo a los plantones de cedro colorado (Cedrela
odorata L.), regular su metabolismo vegetal y constituirse en un buen
complemento para una fertilización integral aplicada al suelo, dado que se
generan además, relaciones antagónicas y de competencia con diferentes
microorganismos fitopatógenos, colaborando de esta forma en la prevención y
combate de enfermedades en las plantas.
De acuerdo a lo
planteado por SÁENZ et al. (2010), el valor (< 6,0) de la relación
altura/diámetro o índice de robustez, indica que en la totalidad de
tratamientos incluido el testigo, los plantones presentan calidad alta (T0 =
2,5; T1 = 2,5; T2 = 2,5; T3 = 2,4; T4 = 2,4; T5 = 2,5 y T6 = 2,5). Así mismo lo
menciona RODRÍGUEZ (2008) sostiene al respecto, que el índice de robustez es la
relación entre la altura del brinzal (cm) y el diámetro del cuello de la raíz
(mm), debiendo ser menor a seis; asimismo afirma que es un indicador de la
resistencia de la planta a la desecación por el viento, de la supervivencia y
del crecimiento potencial en sitios secos. El menor valor indica que se trata
de plantones más bajos y gruesos, aptos para sitios con limitación de humedad;
mientras valores superiores a seis los dispone a los daños por viento, sequía y
helada.
según lo
propuesto por SÁENZ et al. (2010), la relación tallo/raíz (< 2,0) muestra
que los plantones producidos con los tratamientos T0 = 1,8; T1 = 1,8; T3 = 1,8;
T4 = 1,8 y T6 =1,8, presentan calidad alta; en tanto los correspondientes a los
tratamientos T2 = 2,0 y T5 = 2,0 muestran calidad media (para un rango de 2,4 –
2,0). LEYVA et al. (2008) refiere, asimismo, que el desarrollo del sistema
radical depende del agua que contenga el sustrato, lo que determina su
crecimiento y desarrollo. Si una planta recibe agua en abundancia no estimulará
demasiado el crecimiento de la raíz, pero si el agua escasea, será necesario
que la planta tenga un sistema radical amplio para que sobreviva. Sostiene
también, que la inducción de un estrés hídrico moderado al final del periodo
vegetativo detiene el crecimiento en altura, mientras que el diámetro del
cuello de la raíz continúa creciendo, debido probablemente al crecimiento
radical. Transcurridos los 150 días del experimento y según SÁENZ et al.
(2010), el Índice de Calidad de Dickson obtenido (por encontrarse en un rango
de 0,2 - 0,4), evidencia que los plantones de la totalidad de tratamientos
incluido el testigo, presenta calidad media (T0 = 0,3; T1 = 0,3; T2 = 0,3; T3 =
0,3; T4 = 0,4; T5 = 0,4 y T6 = 0,4).
Fonseca et al.
(2002), citado por GARCÍA (2007), afirma que este índice es el mejor parámetro
para indicar la calidad de planta, dado que expresa el equilibrio de la
distribución de la masa y la robustez, evitando seleccionar plantas
desproporcionadas y descartar planta de menor altura, pero con mayor vigor.
Asimismo, Dickson et al. (1960), citados por PRIETO et al. (1999) sugieren que,
a mayor valor del índice, mejor calidad de planta.
CONCLUSIONES
La mayor altura
de plantones (19,70 cm) se produjo con el T5 (150 mL de AFLF/20 L agua),
seguido por el T4 (100 mL de AFLH/20 L agua) con 19,56 cm; en tanto la menor
altura (18,76 cm) se generó con el T1 (50 mL de AFLF/20 L agua). Así mismo se
determinó mayor diámetro de plantones (8,32 mm) que se obtuvo con el T4 (100 mL
de AFLH/20 L agua), seguido del T3 (100 mL de AFLF/20 L agua) con 8,07 mm; por
su parte, el menor diámetro (7,41 mm) se produjo con el T0, por otro lado la
relación tallo/raíz (< 2,0) muestra que los plantones producidos con los
tratamientos T0 = 1,8; T1 = 1,8; T3 = 1,8; T4 = 1,8 y T6 =1,8, presentan
calidad alta; en tanto los correspondientes a los tratamientos T2 = 2,0 y T5 =
2,0 muestran calidad media (para un rango de 2,4 – 2,0) y finalmente el Índice
de Calidad de Dickson obtenido (por encontrarse en un rango de 0,2 - 0,4),
evidencia que los plantones de la totalidad de tratamientos incluido el
testigo, presentan calidad media (T0 = 0,3; T1 = 0,3; T2 = 0,3; T3 = 0,3; T4 =
0,4; T5 = 0,4 y T6 = 0,4).
REFERENCIAS
BIBLIOGRÁFICAS
[1]
Abreu,
José Luis. (2014). El Método de la Investigación. Daena: International Journal of Good
Conscience. 9(3)195-204.
Diciembre 2014. ISSN 1870-557X. http://www.spentamexico.org/v9-n3/A17.9(3)195-204.pdf
[2]
ARROYO,
R.N. 2009. Enmiendas orgánicas. Costa Rica. 29 p.
[3]
BERGER,
N. 2013. 5 soluciones caseras para fertilizar las plantas. [En línea]:
Naturarla, (http://www.naturarla.es/5-soluciones-caseras-para-fertilizar-las-plantas,
documentos, 10 oct. 2016).
[4]
BIRCHLER,
T., ROSE, R.W., ROYO, A., PARDOS, M. 1998. La planta ideal: revisión del
concepto, parámetros definitorios e implementación práctica. Investigación
Agraria: Sistemas y Recursos Forestales, Oregon State University, Oregon. EE.
UU y Universidad Politécnica de Madrid, España. 7:109-121.
[5]
BRAVO,
M.A. 2007. Estimación maderable y evaluación financiera de plantaciones
forestales comerciales de cedro y caoba en Oaxaca, México. Tesis de Maestría.
Colegio de posgraduados Montecillo Texcoco estado de México. 99 p.
[6]
CESTA
(CENTRO EL SALVADOREÑO DE TECNOLOGÍAS APROPIADAS). 2013. Elaboración de
insumos orgánicos. El Salvador. 16 p. [En línea]: FOE-CESTA
(http://www.cesta-foe.org.sv/areas-de-trabajo/Pubs/ CESTA
%20INSUMOS%20ORGANICOS.pdf, documentos, 02 ago. 2014).
[7]
CORECAF
(CORPORACIÓN ECUATORIANA DE CAFETALERAS Y CAFETALEROS). 2005. Cartilla de
Agricultura Orgánica. Ecuador. 12 p.
[8]
DE LA
TORRE, A., LÓPEZ, C., YGLESIAS, E., CORNELIUS, J.P. 2008. Genetic (AFLP)
diversity of nine Cedrela odorata populations in Madre de Dios, southern
Peruvian Amazon. Forest Ecology and Management. 255(2):334-339.
[9]
DOMÍNGUEZ,
L.S., HERRERO, S.N, CARRASCO, M.I., OCAÑA, B.L., PEÑUELAS, R.J.L. 1997.
Ensayo de diferentes tipos de contenedores para Quercus ilex, Pinus halepensis,
Pinus pinaster y Pinus pinea: resultados de vivero. In: Actas del II Congreso
Forestal Español. Puertas F., y Rivas M. (eds.). Pamplona. Mesa 3:189-194.
[10] GARCÍA, M.A. 2006.
Control y mejora de la calidad del proceso productivo. Jornada de Difusión y
Capacitación para Viveristas Forestales del Noreste de Entre Ríos. INTA.
Concordia, Entre Ríos, Argentina. p. 1-15. [En línea]: INTA,
(http://www.inta.gov.ar/CONCORDIA/info/
documentos/Forestacion/Jornada%20para%20viveristas%20forestales_EEA%20Concordia%20julio%20de%202006.pdf,
documentos, 15 Oct. 2016).
[11] GARCÍA, M.A. 2007.
Importancia de la calidad del plantín forestal. In: XXII Jornadas Forestales de
Entre Ríos. Área Forestal de la EEA Concordia del INTA. 10 p. [En línea]: INTA,
(http://www.inta.gov.ar/concordia/
info/Forestales/contenido/pdf/2007/312.II.GARCIA.pdf, Journals, 10 Oct. 2016).
[12] GARCÍA, M.J.J. 2002.
Guía para el establecimiento de plantaciones de pinos a raíz desnuda en
Michoacán. Boletín Técnico Núm. 3. Vol. 1. C. E. Uruapan. CIRPAC. INIFAP.
SAGARPA-COFOM. Uruapan, Mich., México. 39 p.
[13] GÓMEZ, D., VÁSQUEZ, M.
2011. Abonos orgánicos. Serie Producción Orgánica de Hortalizas de Clima
Templado. Tegucigalpa, Honduras, Pymerural. 25 p.
[14] LEYVA, R.F., ROSELL, P.R.,
RAMÍREZ, R.A., ROMERO, R.I. 2008. Manejo de endurecimiento por riego para
elevar la calidad de las plantas de Eucalyptus sp. cultivadas en vivero de la
Unidad Silvícola Campechuela. Universidad de Granma. Central del Batey.
Campechuela, Granma, Cuba. 14 p.
[15] MARTÍNEZ, R.M., GARCÍA,
O.X. 2007. Sucesión ecológica y restauración de las selvas húmedas. Boletín
de la Sociedad Botánica de México. 80(2):69-84.
[16] PRIETO, R.J.A., VERA,
C.G., MERLÍN, B.E. 1999. Factores que influyen en la calidad de brinzales y
criterios para su evaluación. Folleto técnico número 12. Campo Experimental
Valle del Guadiana-INIFAP-SAGARPA. Durango, Dgo., México. 23 p.
[17] QUIROZ, M.I., FLORES,
M.L., PINCHEIRA, B.M., VILLARROEL, M.A. 2001. Manual de viverización y
plantación de especies nativas. Instituto Forestal. Valdivia, Chile. 160 p.
[18] RODRÍGUEZ, T.D.A. 2008.
Indicadores de calidad de planta forestal. Universidad Autónoma Chapingo.
México, Mundi Prensa. 156 p.
[19] ROJAS, F. 2002.
Metodología para la evaluación de calidad de plántulas de ciprés (Cupressus
lusitanica Mill.) en vivero. Rev. Chapingo. Serie Ciencias Forestales y del
Ambiente. 8:75-81.
[20] ROYO, A., FERNÁNDEZ, M.,
GIL, L., GONZÁLEZ, E., PUELLES, A., RUANO, R., PARDOS, J.A. 1997. Calidad de
la planta de vivero de Pinus halepensis Mill. destinada a repoblación
forestal. Tres años de resultados en la comunidad Valenciana. Montes.
50:29-39.
[21] SÁENZ, J.T., VILLASEÑOR,
F.J., MUÑOZ, H.J., RUEDA, A., PRIETO, J.A. 2010. Calidad de planta en viveros
forestales de clima templado en Michoacán. Instituto Nacional de
Investigaciones Forestales, Agrícolas y Pecuarias, Uruapan, México. Folleto
Técnico n° 17. 48 p.
[22] SERRADA, H.R., NAVARRO,
C.R.M., PEMÁN, G.J. 2005. La calidad de las repoblaciones forestales: una
aproximación desde la selvicultura y la ecofisiología. Investigación Agraria.
Sistemas y Recursos Forestales. 14:462-481.
[23] TORAL, I.M. 1997.
Concepto de calidad de plantas en viveros forestales. Documento técnico n° 1.
Guadalajara, Jalisco, México, PRODENFO-SEFUNCO. 28 p.
[24] VALENZUELA, O., GALLARDO,
C., ALORDA, M., GARCÍA, M.A., GARCÍA, D. 2005. Características de los
sustratos utilizados por los viveros forestales. IDIA XXI. 8:55-57.
[25] VILLAR, S.P., PLANELLES,
R., ENRÍQUEZ, E., PEÑUELAS, R.J.L., ZAZO, M.J. 2001. Influencia de la
fertilización y el sombreo en el vivero sobre la calidad de planta de Quercu
ilex L. y su desarrollo en campo. Actas del III Congreso Forestal Español.
Junta de Andalucía (ed.). Consejería de Medio Ambiente. Granada, España.
3:770-776.





